При изучении естественных наук в современной школе огромное значение имеет наглядность учебного материала. Наглядность дает возможность быстрее и глубже усваивать изучаемую тему, помогает разобраться в трудных для восприятия вопросах, и повышает интерес к предмету.
Цифровые лаборатории — оборудование и программное обеспечение для проведения демонстрационного и лабораторного эксперимента на занятиях естественнонаучного цикла.. Цифровая лаборатория даёт возможность обучающимся познавать мир с помощью эмпирических методов, вовлекает их в активное взаимодействие с объектом изучения и значительно повышает уровень знаний, глубину понимания и восприятия явлений окружающей действительности. Оборудование цифровой лаборатории универсально, может быть включено в разнообразные экспериментальные установки, проводить измерения в «полевых условиях», экономить время учеников и учителя, побуждает учеников к творчеству, давая возможность легко менять параметры измерений. Кроме того, программа для видеоанализа позволяет получать данные из видеофрагментов, что позволяет использовать в качестве примеров и количественно исследовать реальные жизненные ситуации.
Розыгрыш над учителем в школе,выключили проектор
Холкина Лидия Анатольевна
Содержимое разработки

Преподавание химии в школе с использованием цифровых лабораторий

важнейший метод познания — позволяет сформировать у школьников знания о веществах и явлениях, развить их активную познавательную деятельность .

Преимущества цифровой лаборатории

- наглядное представление результатов эксперимента в виде графиков, диаграмм и таблиц;
- хранение и компьютерная обработка результатов эксперимента, данных измерений;
- сопоставление данных, полученных в ходе различных экспериментов; возможность многократного повторения эксперимента;
- наблюдение за динамикой исследуемого явления; доступность изучения быстро протекающих процессов;
- сокращение времени эксперимента; быстрота получения результата;
- возрастание познавательного интереса учащихся.

- Аналогово-цифровой преобразователь
- Персональный компьютер
Основные направления использования цифровых лабораторий

- Проектная деятельность
- Полевые исследования
- Факультативные занятия
- Регулярные уроки
Принципы организации эксперимента

- Наглядность;
- Простота;
- Доступность для понимания;
- Конкретность;
- Целостность;
- Кратковременность;
- Безопасность;
- Воспроизводимость.

- Умение самостоятельно формировать программу эксперимента;
- Умение осуществлять наблюдение (эксперимент);
- Умение самостоятельно оформлять отчет .
Применимость цифровых лабораторий
— Изучение кислотно-основных равновесий в водных растворах
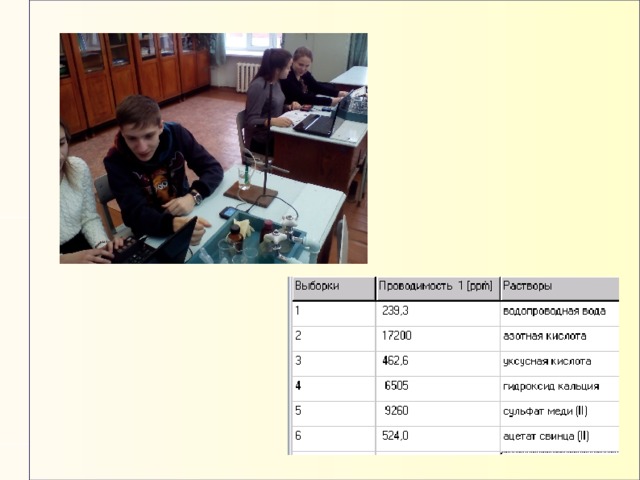
— Изучение электропроводности сильных и слабых электролитов
— Изучение процесса горения
— Исследование испарения органических и неорганических веществ
— Зависимость скорости реакций от температуры
— Влияние катализатора на скорость химических реакций

ВЛИЯНИЯ КАТАЛИЗАТОРА НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Цель : определить влияние катализатора на скорость
Катализатор – это вещество, не расходующееся в процессе протекания реакции, но влияющее на ее скорость.
Концентрация кислорода, %
В растворе Н 2 О 2
При добавлении FeCl 3
При добавлении MnO 2

Контрольные вопросы
1. Рассчитайте скорость реакции для каждого из катализаторов и сравните во сколько раз скорость реакции с оксидом марганца ( IV ) выше, чем с хлоридом железа ( III ).
2. Где применяются каталитические реакции?
3. Какие вещества в природе и в живых организмах являются катализаторами?

ИЗУЧЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ СИЛЬНЫХ И СЛАБЫХ ЭЛЕКТРОЛИТОВ (9 кл)
— исследовать электропроводность различных веществ;
— определить какие из веществ являются сильными электролитами, а какие слабыми.

ИЗУЧЕНИЕ ПРОЦЕССА ГОРЕНИЯ (11 кл)
Цель : определить факторы, которые влияют на химический
Горение – это быстро протекающее химическое превращение, сопровождающееся выделением значительного количества тепла и обычно ярким свечением (пламенем).
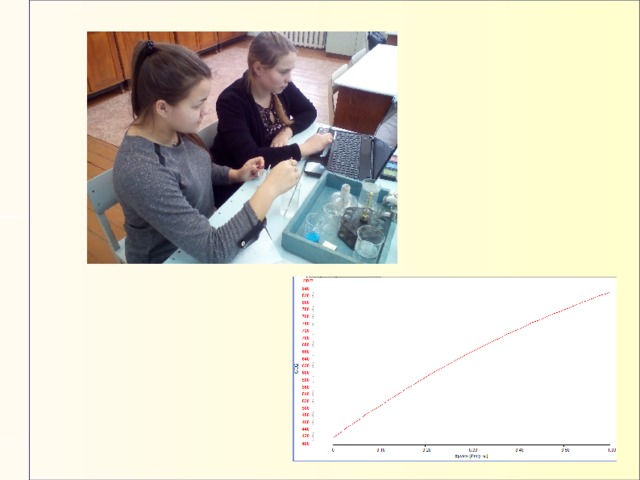

Контрольные вопросы
1. Объясните, почему свеча погасла.
2. Изучите график и определите количество кислорода в то время, когда свеча погасла.
3. Какие продукты образуются при горении свечи.
4. Какие средства тушения пожара нужно использовать в следующих случаях: а) загорелась одежда на человеке; б) воспламенился бензин; в) возник пожар на складе лесоматериалов; г) загорелась нефть на поверхности воды?

ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ (11 кл)
Цели : — закрепить понятие скорость химической реакции;
— исследовать влияние температуры на скорость химической реакции.
Химические реакции протекают с различными скоростями. Знание скоростей химических реакций имеет большое научное и практическое значение.



- Цифровые лаборатории позволяют поднять на новый уровень химический эксперимент в общеобразовательных школах;
- Применение концепции проблемного обучения в дополнение к использованию цифровых лабораторий позволяет приблизить химический эксперимент к реальному пути поиска научного знания.
Спасибо за внимание!

- Зимина А.И. Методика эффективного использования цифровых лабораторий на уроках химии в общеобразовательной школе. 2012.
- Жилин Д.М. Учебно-методический комплекс для 8-9 кл. 2010.

-82%
Источник: videouroki.net
Демонстрации некоторых химических опытов в рамках школьного курса химии основного общего образования

Демонстрационный эксперимент по химии является эффективным средством формирования интереса к предмету у школьников, в рамках учебной дисциплины «Химия» в курсе основного общего образования (8 — 9 классы).
Как в 8-х так и в 9-х классах проводятся занимательные опыты:
«Кровь без раны»
Готовят растворы хлорида железа (III) и роданида аммония. Ваткой, смоченной раствором хлорида железа (III) протирают ладонь, а тупой нож смачивают раствором роданида аммония. Проводят ножом по ладони. Появляются капли «крови».
«Волшебная палочка»
Готовят смесь: 0,5 г перманганата калия и 3 — 4 капли серной кислоты (конц.). Отпускают в эту смесь стеклянную палочку, которой затем касаются фитиля спиртовки. Спиртовка загорается.
В соответствии с учебной программой в 8 классе проделывают демонстрационные опыты:
Опыт 1: «Взаимодействие мрамора с соляной кислотой».
Реактивы: Мрамор, соляная кислота, известковая вода.
Оборудование: Штатив, пробирки, газоотводная трубка, фарфоровая чашка, спиртовка.
Ход опыта: В пробирку помещают кусок мрамора и наливают соляную кислоту. Выделяющийся газ пропускают через раствор известковой воды. Она мутнеет. По окончании реакции несколько капель полученного раствора выпаривают в фарфоровой чашке. Образуется налёт минеральной соли — хлорида кальция.
Вывод: При взаимодействии двух веществ — соляной кислоты и мрамора — были получены совершенно новые вещества — углекислый газ и хлорид кальция.
Опыт 2: «Действие щелочей и кислот на индикаторы».
Реактивы: Растворы щелочи и кислоты в воде, фенолфталеин, лакмус метиловый оранжевый.
Оборудование: Штатив с пробирками.
Ход опыта: В три пробирки наливают раствор щелочи, добавляют индикаторы. Проделывают данные операции с раствором кислоты.
Вывод: В кислой среде лакмус приобретает красную окраску, фенолфталеин – бесцветный, метиловый оранжевый – розовый. В нейтральной среде: лакмус – фиолетовый, фенолфталеин – бесцветный, метиловый оранжевый – оранжевый. В щелочной среде: лакмус – синий, фенолфталеин – малиновый, метиловый оранжевый – желтый.
Опыт 3: «Возгонка йода» (видеодемонстрация).
Оборудование: Пробирка, штатив, спиртовка.
Ход опыта: В пробирку, закреплённую в штативе, помещают небольшое количество кристаллического йода. Нагревают.
Вывод: При лёгком нагревании происходит возгонка йода.
В соответствии с учебной программой в 9 классе проделывают демонстрационные опыты:
Опыт 1: «Взаимодействие щелочных металлов с водой».
Реактивы: Металлический натрий (калий), вода, фенолфталеин.
Оборудование: Кристаллизатор, нож, фильтровальная бумага.
Ход опыта: В воду капают несколько капель фенолфталеина. Отпускают в воду небольшой кусок натрия, предварительно очистив его от оксидной плёнки. Фенолфталеин приобретает малиновую окраску.
Вывод: Щелочные металлы при взаимодействии с водой образуют щёлочи.
Опыт 2: «Демонстрация оксидной плёнки алюминия».
Реактивы: Алюминиевая проволока.
Оборудование: Штатив, спиртовка.
Ход опыта: Нагревают алюминиевую проволоку. Проволока размягчается, металл превращается в жидкость. Продолжают нагревать проволоку ещё несколько минут. Расплавленный алюминий не теряет форму проволоки, из-за присутствия на её поверхности оксидной плёнки.
Вывод: Оксид алюминия — тугоплавкое вещество.
Опыт 3: «Получение хлороводорода и его растворение в воде».
Реактивы: Хлорид натрия, серная кислота (конц.), индикаторная бумага, вода.
Оборудование: Штатив, пробирки, газоотводная трубка.
Ход опыта: Проводят реакцию взаимодействия хлорида натрия с водой. Поток выделяющегося газа направляют в пробирку с водой. Среду раствора определяют с помощью индикаторной бумажки.
Вывод: Хлороводород — газ, который легко растворяется в воде. В пробирке образуется соляная кислота.
Заключение
В процессе исследования нам удалось рассмотреть сущность познавательного интереса школьников на уроках химии. В школьной практике мотивация на учёбу чаще всего выступает в форме интереса, который проявляют ученики при проведении демонстрационного эксперимента на уроках химии. Глубокие интересы могут возникнуть только на основе внутренней мотивации. Поскольку основной потребностью человека является познание мира и утверждение себя в нем, в учебной деятельности, обеспечивающей это познание, заложен мощный источник внутренней мотивации. Задача педагога заключается в раскрытии внутреннего потенциала.
А также рассмотрели виды демонстрационного эксперимента в школьном курсе, изучили проблему использования школьного химического эксперимента, потому что она является одной из наиболее разработанных в методике, так как именно она более других отражает специфику учебного предмета. Демонстрационный эксперимент и натуральные объекты помогают изучать свойства веществ, внешнее проявление химической реакции. Демонстрация химических опытов на лекциях дает эмоциональную разгрузку, поднимает интерес к изложению учебного материала, позволяет сделать смысловую паузу и тем самым способствует лучшему усвоению курса химии. Помимо демонстрационного эксперимента, в арсенале современного учителя химии имеется множество других средств наглядности, которые при правильном использовании повышают эффективность и качество урока (интерактивные средства обучения, таблицы, модели, макеты, internet-ресурсы).
Изучили методику демонстрации эксперимента на уроке химии в 8 — 9 классах в соответствии с учебной программой.
Список литературы
1. Батина Е.В. Общая методика обучения химии: методическое пособие [Текст]. Ярославль: Изд-во ЯГПУ, 2011. — 106 с.
2. Верховский В.Н. Техника и методика химического эксперимента в школе: Пособие для преподавателей и студентов педвузов [Текст]. — М.: Учпедгиз. — Т 1: Приборы, материалы, приёмы работы и описание опытов. — 2010. — 544 с.
3. Головнер В.Н. Интересные уроки. М.: «НЦ ЭНАС»,2005. – 56-60с.
4. Зуева М.В. Школьный химический практикум, 8 – 9 классы. М.: «Дрофа», 2013.-89-103 с.
5. Маринива Д. Л. Журнал «Химия в школе», № 2, 3, 2005.-8-10 с.
Источник: megaobuchalka.ru
Новогодняя химия: 5 опытов, которыми можно развлечь детей на уроке
Фотографии: Depositphotos / Иллюстрации: Юлия Замжицкая
Последний урок химии в уходящем году должен стать запоминающимся для школьников. Рассказываем, какие несложные, но яркие опыты можно провести в классе.
1. Зима в стакане
Опыт заключается в сублимации бензойной кислоты и ее оседании на еловой ветке. Бензойная кислота является органическим веществом, которое может переходить из твердого состояние в газообразное без жидкой фазы и благодаря этому давать красивые эффекты.
Что нужно:
- Термостойкая или боросиликатная стеклянная посуда.
- Еловая ветка.
- Бензойная кислота.
- Спиртовка.
Инструкция:
- Насыпьте небольшое количество кислоты в стакан.
- Положите внутрь стакана еловую ветку, чтобы на ней оседали пары бензойной кислоты.
- Подожгите спиртовку и поставьте на нее стакан для нагревания. Через некоторое время кислота начинает сублимироваться, и стакан наполняется парами.
- Снимите стакан с огня, чтобы он остыл.
- После остывания пары бензойной кислоты начинают оседать на еловой ветке и стенках стакана и создавать эффект пушистого снега
Еще больше полезных материалов — в Телеграм-канале Педсовета. Подписывайтесь, чтобы не пропускать свежие статьи и новости.
2. «Золотой дождь»
В ходе реакции образуется йодид свинца, который дает красивый золотой цвет с перламутровым переливом. Эксперимент можно повторять неограниченное количество раз — достаточно только нагреть раствор, чтобы йодид растворился.
Что нужно:
- Нерастворимая соль свинца (1г).
- Йодид калия (1г).
- Уксусная кислота.
- 250 мл дистиллированной воды.
- Емкость для проведения опыта.
- Стакан для приготовления раствора.
Инструкция:
- Засыпьте йодид калия в колбу.
- Нитрат засыпьте в стакан для приготовления раствора.
- Добавьте уксусную кислоту в нитрат.
- Вскипятите 250 мл дистиллированной воды и добавьте поровну в обе емкости.
- Постоянно перемешивая жидкость, дождитесь полного растворения вещества.
- Добавьте нитрат свинца к йодиду калия небольшими порциями.
3. Снежная лавина
При взаимодействии с водой абсорбент начинает раздуваться и создает эффект пушистого снега. Получившимся веществом можно засыпать елку или использовать как элемент декора.
Что нужно:
- Полиакрилат натрия (он, например, содержится в подгузнике).
- Ножницы.
- Емкость для приготовления раствора.
- Вода.
Инструкция:
- Заполните 1/ 3 стакана водой.
- Высыпьте в стакан полиакрилат натрия.
- Дождитесь полного разбухания абсорбента и вытащите получившийся «снег» из стакана.
4. Фейерверк в стакане
Опыт демонстрирует реакцию серной кислоты и спирта на кристалл перманганата калия. В итоге у вас получается яркий фейерверк на дне стакана.
Что нужно:
- Серная кислота.
- Прозрачная емкость.
- Перманганат калия.
- Спирт.
- Прозрачная емкость для приготовления раствора.
Инструкция:
- Налейте серную кислоту в емкость.
- Добавьте туда спирт в пропорции 1:1.
- Засыпьте кристаллы перманганата калия.
- Выключите свет (иначе опыт будет недостаточно яркий).
5. Горячий лёд
Опыт показывает, как с помощью простых веществ — соды и уксуса — образовывается «горячий лед». Полученный раствор кристаллизуется с выделением большого количества тепла. Благодаря этому получившиеся кристаллы можно переплавить и вновь использовать в опыте.
Что нужно:
- Уксусная кислота 70% (100 гр.).
- Сода пищевая (97,8 гр.).
- Вода (20 мл).
- Высокая емкость.
- Кристаллы ацетата натрия.
Инструкция:
- Налейте уксусную кислоту в емкость.
- Добавьте к ней соду и воду.
- Подождите, пока образуется тригидрат ацетата натрия (понадобится около 10 часов). Он будет похож на талый снег.
- Поставьте емкость на плиту и, постоянно помешивая, растворите содержимое до прозрачной жидкости.
- Охладите раствор до комнатной температуры.
- Нанесите небольшое количество кристаллов ацетата натрия на кончики пальцев и опустите их в емкость.
- Дождитесь реакции. Вокруг вашей руки начнут образовываться кристаллы, похожие на треснувший лед.
Материалы по теме:
- Необычные новогодние «ёлки» России: огонь, вода и джем-сейшен на барабанах;
- Как мотивировать детей на учебу в конце года. Советы учителям «началки»;
- Что посмотреть в кино с детьми на новогодних каникулах.
Если вам нравятся материалы на Педсовете, подпишитесь на наш канал в Телеграме, чтобы быть в курсе событий раньше всех.
Источник: pedsovet.org
